Oddbjørn Nevestveit i Oljedirektoratet kommenterer artikkelen til Fridtjof Riis «Undertrykk i nord» og beskriver hvordan dannelse av gasshydrater kan forklare fenomenet.
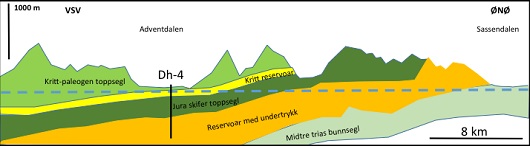 UNDERTRYKK PÅ SVALBARD: Skjematisk profil gjennom boringen ved Longyearbyen. Blå stiplet linje viser bunnen av permafrosten. Undertrykket er forseglet av permafrost der lagene kommer opp i dagen mot Sassendalen i ØNØ. Illustrasjon: Fridtjof Riis
UNDERTRYKK PÅ SVALBARD: Skjematisk profil gjennom boringen ved Longyearbyen. Blå stiplet linje viser bunnen av permafrosten. Undertrykket er forseglet av permafrost der lagene kommer opp i dagen mot Sassendalen i ØNØ. Illustrasjon: Fridtjof Riis
Dette er en kommentar til artikkelen «Undertrykk i nord» i geoforskning.no 22. februar 2016, der Fridtjof Riis omtaler undertrykk i Fingerdjupsunderbassenget i Barentshavet, og antyder at forekomster av gasshydrat kan være medvirkende årsak til undertrykket.
En mulig forklaring på undertrykk i en geologisk formasjon, er at selve dannelsen av gasshydrat i seg selv kan forårsake trykkreduksjon i formasjonen.
Dersom gasshydrater dannes i et system som er isolert fra omverden med hensyn på materialutveksling og trykkutveksling, altså i en isokor prosess, kan dette medføre trykkreduksjon i systemet.
Termodynamiske betraktninger
Fra litteraturen finner vi at dekomposisjon av metanhydrat, til metangass og vann, fører til et gassvolum som er rundt 160 ganger volumet av hydratet (ved standard temperatur og trykk).
Den motsatte prosessen, gasshydratdannelse, betyr at et tilsvarende gassvolum komprimeres med en faktor 160, med tilhørende trykkfall i den gjenværende gassen.
Vi ser på en forenklet modell der vann og metan omdannes til metanhydrat I, (CH4)8(H2O)46, som er det vanligst forekommende hydratet, i en isokor prosess.
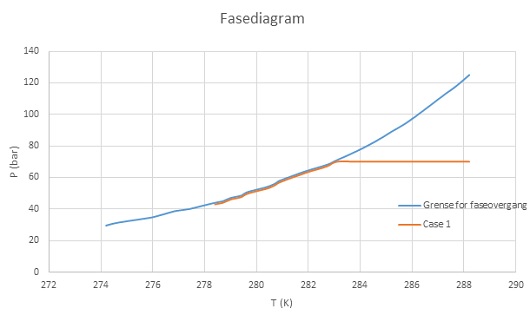 Figur 1. Fasediagram for metanhydrat I, (CH4)8(H2O)46. metan CH4 og vann H2O. Hydratet er stabilt i området over/til venstre for den blå linjen, men dissosierer til vann og metan i området under/til høyre for linjen. Den oransje linjen illustrerer et system med vann og metan som kjøles ned (fra høyre mot venstre). Når hydratdannelsen starter opp, vil trykket reduseres i samsvar med fasediagrammet.
Figur 1. Fasediagram for metanhydrat I, (CH4)8(H2O)46. metan CH4 og vann H2O. Hydratet er stabilt i området over/til venstre for den blå linjen, men dissosierer til vann og metan i området under/til høyre for linjen. Den oransje linjen illustrerer et system med vann og metan som kjøles ned (fra høyre mot venstre). Når hydratdannelsen starter opp, vil trykket reduseres i samsvar med fasediagrammet.
Case 1 eksempel:
Et reservoar med metan og vann (P = 70 bar i gassen øverst i reservoaret) blir kjølt ned til 10℃, og videre ned til 5 ℃. Det vil da dannes metanhydrat, og trykket reduseres til ca. 43 bar i gassen.
Gasshydratet metanhydrat I har empirisk formel (CH4)8(H2O)46. Vi har altså at ett mol CH4 og 5.75 mol H2O danner ett mol (CH4) (H2O)5.75.
Vi regner at metan tilnærmet oppfører seg som en ideell gass i det aktuelle trykk- og temperaturintervallet, og antar at vannets tettet er tilnærmet konstant.
I en ideell gass gjelder at pV=nRT, der p = gasstrykket, V = volum, n = antall mol, T = temperatur, og R = 8,31 JK-1·mol-1 (den ideelle gasskonstanten).
Molvekt for CH4: MCH4=16,043, Molvekt for H2O: MH2O=18,015. Molvekt for (CH4)8(H2O)46 blir 957,04, eller M(CH4) (H2O)5.75= 16,043 + 5,75×18,015 = 119,63. Til å danne ett mol (119,63 g) metanhydrat, (CH4) (H2O)5.75, går det med ett mol CH4, og 5,75 mol H2O.
Metanhydrat I har egenvekt på ca. 0,9 g/cm3, og ett mol okkuperer et volum på ca. 119,63/0,9 cm3 = 132,9 cm3. Mengden vann som går med til dette, er 5,75 mol H2O = 5,75x 18,015/1,0 cm3=103,6 cm3. Volumdifferansen blir 132,9 cm3 – 103,6 cm3 = 29,3 cm3. Det går med 1 mol metangass CH4.
Ved dannelse av n mol hydrat, blir gjenværende gassmengde n2=n1-n og gjenværende gassvolum V2= V1-n x 29,3 cm3. Fra p1V1=n1RT1 og p2V2=n2RT2 får vi at p2(n1RT1/p1-n x 29,3 cm3)= (n1– n) x RT2
Hvor stor andel (f) av den opprinnelige metangassen vil omdannes til metanhydrat i prosessen, dersom ikke andre mekanismer bidrar?
Ved å sette inn i ligningene ovenfor, får vi:
f = n/n1 = (T1 p2/p1– T2)/ (p2R-1 x 29,3 cm3 – T2 )
Med T1=283K (10 ℃), T2 gradvis fallende til 278K (5 ℃), p1=70 bar = 7,0 MPa, og p2 minkende til 43 bar = 4,3 MPa, får vi tabellen nedenfor:
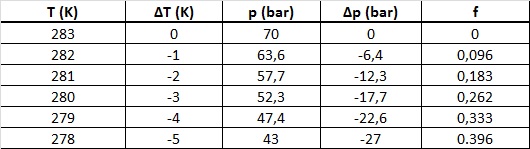 Tabell 1. Beregnet trykkreduksjon Δp og fraksjon (f) av metan CH4 som blir omdannet til hydrat (CH4)8(H2O)46 under en isokor avkjølingsprosess i grenseområdet for hydratdannelse
Tabell 1. Beregnet trykkreduksjon Δp og fraksjon (f) av metan CH4 som blir omdannet til hydrat (CH4)8(H2O)46 under en isokor avkjølingsprosess i grenseområdet for hydratdannelse
Diskusjon og konklusjon
Termodynamiske betraktninger ser ut til å støtte opp om den hypotesen at dannelse av gasshydrat i et lukket reservoar kan føre til trykkreduksjon i reservoaret.
Av andre mekanismer som kan tenkes å bidra i en eller annen retning, er tetthetsendring i vannet som funksjon av temperatur- og trykkendring, metan oppløst i vannet, og vanndamp oppløst i metangassen.
Dersom det er lite gass i forhold til mengden vann i reservoaret, vil ekspansjonen av vannet (som følge av trykkreduksjon) bidra til å dempe trykkreduksjonen.
I virkelighetens verden vil systemet selvsagt bestå av flere komponenter, blant annet ulike hydrokarbontyper, og det vil dannes hydrater med andre egenskaper.



